一、价电子和价层电子的区别是什么?那它们的排布图有什么区别?
价电子和价层电子的区别:价电子排布式是表现化合价的电子的排布式,主族元素就是最外层电子的排布式,副族元素还可能包括次外层和倒数第三层上的部分电子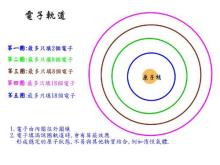
那它们的排布区别:价层电子价层电子是指在一个化合物中,中心原子的价电子层上的电子,它包括中心原子的电子,还包括与中心原子键合的周围原子的电子(即周围原子拿出与中心原子成键的电子)。
对主族,0族元素来讲,最外层电子数就是它的价电子数,最外层电子就是它的价电子。对副族,VIII元素来讲,最外层和次外层电子数就是它的价电子数。
价电子
是原子在参与化学反应时能够用于成键的电子,是原子核外跟元素化合价有关的电子。在主族元素中,价电子数就是最外层电子数。副族元素原子的价电子,除最外层电子外,还可包括次外层电子。例如,铬的价电子层结构是3d54s1,6个价电子都可以参加成键。镧系元素还能包括外数第三层的4f电子。
二、价电子,外围电子,价层电子等是什么
价电子指原子核外电子中能与其他原子相互作用形成化学键的电子。主族元素是最外层电子,过渡元素是最外层电子和次外层电子。
外围电子:是指将过渡元素原子的电子中符合稀有气体的原子的电子的部分去掉,剩下的电子,如:如Cl:1s2
2s2
2p6
3s2
3p5将"1s2
2s2
2p6"(Cl的内层电子排布,也是Ne的电子排布式)省略,"3s2
3p5"即为氯原子的外围电子有7个。同理,Fe原子外围电子排布式为3d6
4s2(省略了Ar的电子排布式1s2
2s2
2p6
3s2
3p6),铁的外围电子有8个。
价层电子指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子。对主族元素来讲,最外层电子数就是它的价电子数,最外层电子就是它的价电子。
三、什么是价电子层构型
价电子构型是指价电子层的电子排布式。如氧原子,价电子层是第二层(l层),价电子构型是2s^2
2p^4.
四、什么是价电子结构,都包括些什么啊
价电子结构分两种情况
一种是主族元素,价电子结构就是最外层的电子,例如Na:最外层1个电子且排在s能级,所以价电子结构为 3S(1 )例如S:最外层6个电子,就是价电子,结构是:3S(2)3P(6)
一种是过度元素,价电子除了最外层电子外,还要加上次外层的电子,一般就是次外层的d电子,例如Cu:除了最外层的一个电子还要加次外层d能级上的10个电子,所以价电子结构为:3d(10)4s(1)
其实价电子结构就是周期表中的外围电子层排布,就是元素符号下方的由s p d f等表示出来的这个数据