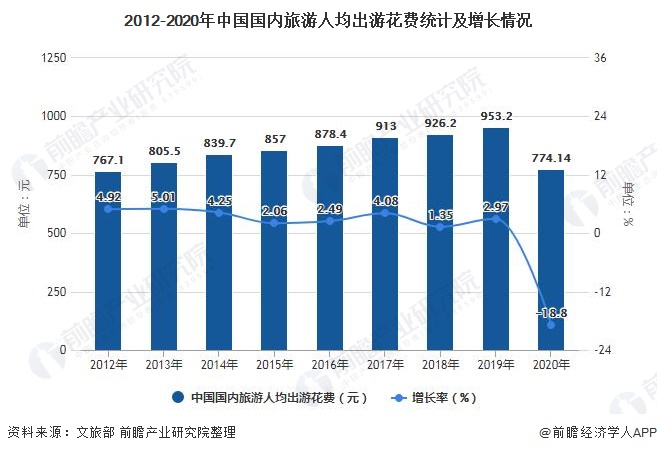
氨和氨盐的性质
氨极易溶于水,溶解度一般取为1体积水溶700体积氨气。生成一水合氨。
一水合氨不稳定受热分解生成氨和水。
跟酸反应
2nh3+h2so4===(nh4)2so4
3nh3+h3po4===(nh4)3po4
若在水溶液中反应,化学方程式为:
8nh3+3cl2===n2+6nh4cl
(黄绿色褪去,产生白烟)
反应实质:2nh3+3cl2===n2+6hcl
nh3+hcl===nh4cl
总反应式:8nh3+3cl2===n2+6nh4cl
铵盐:
铵盐是氨与酸作用得到铵盐,铵盐是由铵离子(nh4+)和酸根离子组成的化合物。一般为无色晶体,易溶于水,是强电解质。
铵盐的化学性质:
①有一定程度的水解。
②受热分解,所有的铵盐加热后都能分解,其分解产物与对应的酸以及加热的温度有关。分解产物一般为氨和相应的酸。
这里有一点要注意的:
氯化铵受热分解成氨气和氯化氢。这两种气体在冷处相遇又可化合成氯化铵。这不是氯化铵的升华,而是它在不同条件下的两种化学反应
③跟碱反应放出氨气
如:nh4cl+naoh===nh3+nacl+h2o
铵盐的性质是什么?
铵盐的性质是:皆为晶体,易溶于水,常伴有吸热现象。
干燥的铵盐能与碱固体混合加热反应生成氨气,利用这个性质可以制备氨气: 2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。
受热易分解放出氨气:NH4Cl NH3↑+HCl↑ NH4HCO3 NH3↑+H2O↑+CO2↑。
铵盐的用途
具有强烈的杀菌和抑霉防蛀性能。氯化十二烷基二甲基苄基铵可用作腈纶的匀染剂。季铵盐分子中的两个烷基是长链烷基的产品,对各种纤维具有良好的柔软作用,能使纤维膨胀柔软,外观美观而平滑,富有良好手感,是一种常用的纤维柔软剂。
溴化双十八烷基二甲基铵,不仅是杀菌剂,而且对棉、毛、合成纤维织物都具有显著的柔软作用。十八烷基二甲基羟乙基铵硝酸盐是一种极好的抗静电剂。
季铵盐还可作防水剂、缓染剂、石油破乳剂等。用脂肪酸为原料,经氨化制得脂肪腈,再经氢化为脂肪胺,然后将伯胺与溴代烷反应,即得季铵盐。亦可用叔胺为原料,在常压下与溴代烷加热直接缩合为季铵盐。
铵盐有什么性质?
皆为晶体,易溶于水,常伴有吸热现象。在水溶液中水解呈弱酸性
共热则出NH3,是铵盐的重要检验方法之一。热分解情况与对应的酸有关。一般非氧化性酸的铵盐热分解产物为NH3与对应酸,如NH4Cl,NH4Br,(NH4)3PO4等。氧化性酸的铵盐热分解比较复杂,产物有N2或其氧化物出现,如:
NH4NO3
N2O+2H2O
NH4NO2
N2+2H2O
(NH4)2Cr2O7
N2+Cr2O3+4H2O
强酸铵盐与弱酸铵盐相比,弱酸铵盐的稳定性差,如(NH4)2CO3在常温就缓慢分解成NH3、CO2和水蒸气而损失
高一化学试验铵盐的性质
反应条件 铵盐与可溶性碱NaOH加热生成NH3,H2O和可溶性Na盐(一般用NaOH比较多,不可以用Ca(OH)2,碳酸铵与它加热生成的碳酸钙受热也会分解,会生成气体杂质 CO2)
试验现象 有气泡产生,说明有气体产生,有刺激性气味,可使试管口湿润的红色石蕊试纸变蓝
结论 NH3易挥发 氨水受热易分解 铵盐可与可溶性碱反应
铵盐性质
氨与酸反应的生成物都是由铵离子和酸根离子构成的离子化合物,这类化合物称为铵盐。
1.铵盐是离子型化合物,都是白色晶体,易溶于水,溶水时吸热。 2.受热分解(不稳定性) NH4Cl == NH3↑ + HCl↑ NH4HCO3 == NH3↑ + CO2↑ + H2O(条件均为加热) 氯化铵受热分解为氯化氢和氨气,遇冷时二者又重新结合为氯化铵,类似于“升华”现象,但不同于I2的升华。NH4HCO3加热则完全气化,也出现类似“升华”的现象。 铵盐受热分解的产物要根据具体情况分析,一般与温度和铵盐里的酸根的氧化性等诸多因素有关。 如:NH4NO3===440K===N2O↑+2H2O 3.与碱反应 NH4+ + OH- == NH3↑ + H2O(加热) 可以用来检验NH4+ 也可用来制作氨气。 用湿润红色石蕊试纸在瓶口验满。
帮我总结下铵盐的通性,高中范围内就可以,谢谢
1.铵盐是离子化合物,都是晶体,易溶于水。
2.受热分解(不稳定性)
盐分解时有以下三种情况:
①组成铵盐的酸根离子对应的酸是非氧化性的挥发性酸时,则加热时生成的酸与氨气同时挥发,冷却时又重新化合生成铵盐。
②组成铵盐的酸根离子对应的酸是难挥发性酸,加热时则只有氨气逸出,酸或酸式盐仍残留在容器中。
③组成铵盐的酸根离子对应的酸是氧化性酸,加热时一般发生氧化还原反应,无氨气逸出。
NH4Cl == NH3↑ + HCl↑
NH4HCO3 == NH3↑ + CO2↑ + H2O(条件均为加热)
氯化铵受热分解为氯化氢和氨气,遇冷时二者又重新结合为氯化铵,类似于“升华”现象,但不同于I2的升华。NH4HCO3加热则完全气化,也出现类似“升华”的现象。
铵盐受热分解的产物要根据具体情况分析,一般与温度和铵盐里的酸根的氧化性等诸多因素有关。
3.与碱反应
NH4+ + OH- == NH3↑ + H2O(加热)
可以用来检验NH4+ 也可用来制作氨气。